一、内镜诊断
1.胃镜检查
(1)筛查:
1)筛查对象:胃癌在一般人群中发病率较低(33/10 万),内镜检查用于胃癌普查需要消耗大量的人力、物力资源,且患者接受度低。因此,只有针对胃癌高危人群进行筛查,才是可能行之有效的方法。我国建议以 40 岁以上或有胃癌家族史者需进行胃癌筛查。
符合下列第1条和第2~6条中任一条者均应列为胃癌高危人群,建议作为筛查对象:
①年龄40 岁以上,男女不限;
②胃癌高发地区人群;
③幽门螺杆菌感染者;
④既往患有慢性萎缩性胃炎、胃溃疡、胃息肉、手术后残胃、肥厚性胃炎、恶性贫血等胃癌前疾病;
⑤胃癌患者一级亲属;
⑥存在胃癌其他高危因素(高盐、腌制饮食、吸烟、重度饮酒等)。
2)筛查方法:见图 1。
血清PG检测:我国胃癌筛查采用 PGⅠ浓度≤70 μg/L且 PGⅠ/PGⅡ≤3.0 作为胃癌高危人群标准。根据血清 PG 检测和幽门螺杆菌抗体检测结果对胃癌患病风险进行分层,并决定进一步检查策略。
胃泌素 17(gastrin-17,G-17):血清 G-17 浓度检测可以诊断胃窦(G-17 水平降低)或仅局限于胃体(G-17 水平升高)的萎缩性胃炎。
上消化道钡餐:X 线钡餐检查可能发现胃部病变,但敏感性及特异性不高,已被内镜检查取代,不推荐使用 X 线消化道钡餐进行胃癌筛查。
内镜筛查:内镜及内镜下活检是目前诊断胃癌的金标准,近年来无痛胃镜发展迅速,并已应用于胃癌高危人群的内镜筛查,极大程度上提高了胃镜检查的患者接受度。

图 1 胃癌筛查方法
(2)内镜检查技术
1)普通白光内镜:普通白光内镜是内镜检查技术的基础,对于病变或疑似病变区域首先进行白光内镜观察,记录病变区域自然状态情况,而后再进行其他内镜检查技术。
2)化学染色内镜:化学染色内镜是在常规内镜检查的基础上,将色素染料喷洒至需观察的黏膜表面,使病灶与正常黏膜对比更加明显。物理染色(靛胭脂、亚甲蓝):指染料与病变间为物理覆盖关系,由于病变表面微结构与周围正常黏膜不同,染料覆盖后产生对光线的不同反射,从而突出病变区域与周围正常组织间的界限。化学染色(醋酸、肾上腺素):指染料与病变区域间发生化学反应,从而改变病变区域颜色,突出病变边界。
3)电子染色内镜:电子染色内镜可通过特殊光清晰观察黏膜浅表微血管形态,常见电子染色内镜包括窄带成像技术、智能电子分光技术及智能电子染色内镜。
4)放大内镜:放大内镜可将胃黏膜放大并观察胃黏膜腺体表面小凹结构和黏膜微血管网形态特征的细微变化,可用于鉴别胃黏膜病变的良恶性,判断恶性病变的边界和范围。
5)EUS:EUS 是将超声技术与内镜技术相结合的一项内镜诊疗技术。用于评估胃癌侵犯范围及淋巴结情况。
6)其他内镜检查技术:激光共聚焦显微内镜:可显示最高可放大 1000 倍的显微结构,达到光学活检的目的。荧光内镜:以荧光为基础的内镜成像系统,能发现和鉴别普通内镜难以发现的癌前病变及一些隐匿的恶性病变。但上述方法对设备要求高,目前在临床常规推广应用仍较少。
(3)胃镜检查操作指南:胃镜检查是确诊胃癌的必须检查手段,可确定肿瘤位置,获得组织标本以行病理检查。内镜检查前必须充分准备,建议应用去泡剂和去黏液剂等。经口插镜后,内镜直视下从食管上端开始循腔进镜,依次观察食管、贲门、胃体、胃窦、幽门、十二指肠球部及十二指肠降部。退镜时依次从十二指肠、胃窦、胃角、胃体、胃底贲门、食管退出。依次全面观察、应用旋转镜身、屈曲镜端及倒转镜身等方法观察上消化道全部,尤其是胃壁的大弯、小弯、前壁及后壁,观察黏膜色泽、光滑度、黏液、蠕动及内腔的形状等。如发现病变则需确定病变的具体部位及范围,并详细在记录表上记录。检查过程中,如有黏液和气泡应用清水或去泡剂和去黏液剂及时冲洗,再继续观察。保证内镜留图数量和质量:为保证完全观察整个胃腔,如果发现病灶,另需额外留图。同时,需保证每张图片的清晰度。国内专家较为推荐的是至少 40 张图片。必要可酌情选用色素内镜/电子染色内镜或放大内镜等图像增强技术。
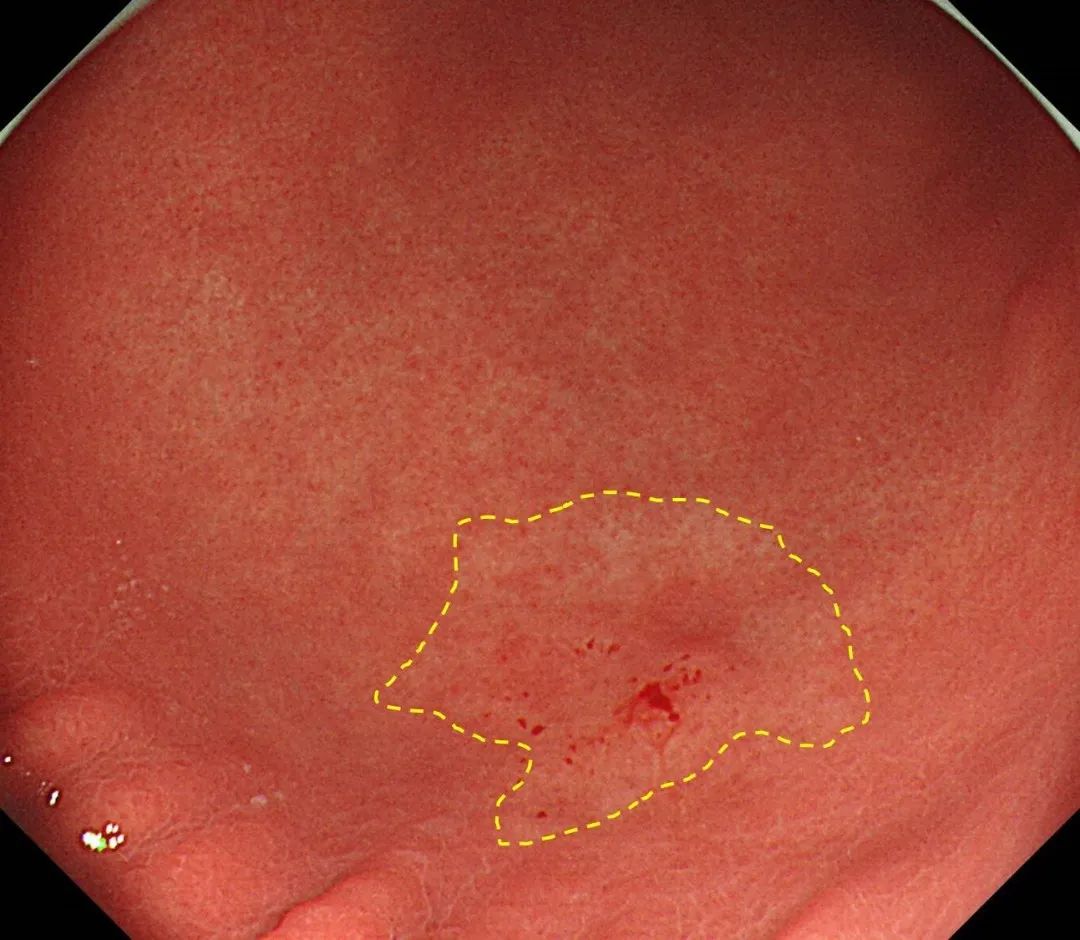
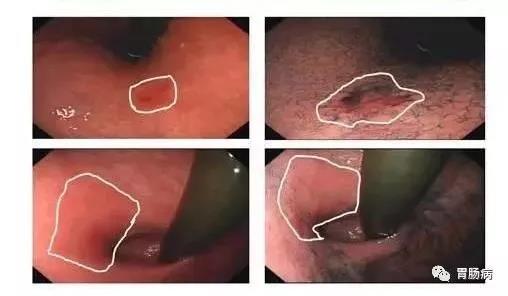
(4)早期胃癌的内镜下分型:见图 2。
1)早期胃癌的内镜下分型依照 2002 年巴黎分型标准及2005 年巴黎分型标准更新。浅表性胃癌(Type 0)分为隆起型病变(0-Ⅰ)、平坦型病变(0-Ⅱ)和凹陷型病变(0-Ⅲ)。0-Ⅰ型又分为有蒂型(0-Ⅰp)和无蒂型(0-Ⅰs)。0-Ⅱ型根据病灶轻微隆起、平坦、轻微凹陷分为 0-Ⅱa、0-Ⅱb 和0-Ⅱc 3 个亚型。
2)0-Ⅰ型与 0-Ⅱa 型的界限为隆起高度达到 2.5 mm(活检钳闭合厚度),0-Ⅲ型与 0-Ⅱc 型的界限为凹陷深度达到1.2 mm(活检钳张开单个钳厚度)。同时具有轻微隆起及轻微凹陷的病灶根据隆起/凹陷比例分为 0-Ⅱc+Ⅱa 及 0-Ⅱa+Ⅱc 型。凹陷及轻微凹陷结合的病灶则根据凹陷/轻微凹陷比例分为 0-Ⅲ+Ⅱc 和 0-Ⅱc+Ⅲ型。

图 2 胃癌的镜下分型示意图
3)早期胃癌精查及随访流程见图 3。

图 3 胃癌精查和随访流程
(5)活检病理检查:
1)如内镜观察和染色等特殊内镜技术观察后未发现可疑病灶,可不取活检。
2)活检部位:为提高活检阳性率,不同类型病变取活检时应注意选取活检部位。

3)怀疑早期肿瘤性病变:直径2cm以下病变取 1~2 块活检,直径每增加1cm可增加1块;倾向进展期癌的胃黏膜,避开坏死的区域,取材 6~8 块。
4)胃镜活检标本处理指南:
①标本前期处置:活检标本离体后,立即将标本展平,使黏膜的基底层面贴附在滤纸上。
②标本固定:置于充足(大于10倍标本体积)的 10%中性缓冲福尔马林溶液(含 4%甲醛)中。包埋前固定时间须大于 6 小时,小于48小时。
③石蜡包埋:去除滤纸,将组织垂直定向包埋。包埋时,烧烫的镊子不能直接接触标本,先在蜡面减热后再夹取组织,防止灼伤组织。
④苏木精-伊红(hematoxylin and eosin,HE)染色制片标准:修整蜡块,要求连续切 6~8 个组织面,捞取在同一张载玻片上。常规 HE 染色,封片。
胃癌的治疗内镜部分
(一)治疗原则
应当采取综合治疗的原则,即根据肿瘤病理学类型及临床分期,结合患者一般状况和器官功能状态,采取多学科综合治疗(MDT)模式(包括胃肠外科、消化内科、肿瘤内科、内镜中心、放疗科、介入科、影像科、康复科、营养科、分子生物学家、生物信息学家等),有计划、合理地应用手术、化疗、放疗和生物靶向等治疗手段,达到根治或最大幅度地控制肿瘤,延长患者生存期,改善生活质量的目的。
1.早期胃癌且无淋巴结转移证据,可根据肿瘤侵犯深度,考虑内镜下治疗或手术治疗,术后无需辅助放疗或化疗。
2.局部进展期胃癌或伴有淋巴结转移的早期胃癌,应当采取以手术为主的综合治疗。根据肿瘤侵犯深度及是否伴有淋巴结转移,可考虑直接行根治性手术或术前先行新辅助化疗,再考虑根治性手术。成功实施根治性手术的局部进展期胃癌,需根据术后病理分期决定辅助治疗方案(辅助化疗,必要时考虑辅助化放疗)。
3.复发/转移性胃癌应当采取以药物治疗为主的综合治疗手段,在恰当的时机给予姑息性手术、放疗、介入治疗、射频治疗等局部治疗,同时也应当积极给予镇痛、支架置入、营养支持等最佳支持治疗。
(二)早期胃癌内镜治疗
早期胃癌的治疗方法包括内镜下切除和外科手术。与传统外科手术相比,内镜下切除具有创伤小、并发症少、恢复快、费用低等优点,且疗效相当,5 年生存率均可超过 90%。因此,国际多项指南和本共识均推荐内镜下切除为早期胃癌的首选治疗方式。早期胃癌内镜下切除术主要包括EMR和ESD。
1.内镜治疗有关定义及术语
(1)整块切除:病灶在内镜下被整块切除并获得单块标本。
(2)水平/垂直切缘阳性:内镜下切除的标本固定后每隔 2 mm 垂直切片,若标本侧切缘有肿瘤细胞浸润为水平切缘阳性,若基底切缘有肿瘤细胞浸润则称为垂直切缘阳性。
(3)完全切除:整块切除标本水平和垂直切缘均为阴性称为完全切除。
(4)治愈性切除:达到完全切除且无淋巴结转移风险。
(5)非治愈性切除:存在下列情况之一者:①非完全切除,包括非整块切除和/或切缘阳性;②存在引起淋巴结转移风险的相关危险因素,如黏膜下侵及深度超过 500μm、脉管浸润、肿瘤分化程度较差等。
(6)局部复发:指术后 6 个月以上原切除部位及周围 1cm 内发现肿瘤病灶。
(7)残留:指术后 6 个月内原切除部位及周围 1 cm 内病理发现肿瘤病灶。
(8)同时性复发:指胃癌内镜治疗后 12 个月内发现新的病灶:即内镜治疗时已存在但被遗漏的、术后 12 个月内经内镜发现的继发性病灶。
(9)异时性复发:指治疗后超过 12 个月发现新的病灶。大部分病灶出现在胃内原发病灶的邻近部位,且病理组织类型相同。
2.内镜治疗术前评估:需根据以下内容判定是否行 ESD或 EMR。
(1)组织学类型:组织病理学类型通常由活检标本的组织病理学检查来确定,虽已有报道指出,组织病理学类型可一定程度通过内镜预测,但尚缺乏充足证据。
(2)大小:采用常规内镜检测方法测量病变大小容易出错,难以准确判断术前病灶大小,因此,一般以切除后组织的测量及病理学检查作为最终检查结果。
(3)是否存在溃疡注意观察病变是否存在溃疡,如存在,需检查是属于活动性溃疡还是溃疡瘢痕。溃疡组织病理定义为至少 UL-Ⅱ深度的黏膜缺损(比黏膜肌层更深)。术前胃镜中,活动性溃疡一般表现为病变表面覆盖白色渗出物,不包括浅表糜烂。此外,溃疡处在愈合或瘢痕阶段时,黏膜皱襞或褶皱会向一个中心聚合。
(4)浸润深度目前常规使用内镜检查来判断早期胃癌的侵犯深度,并推荐使用放大内镜辅助判断。当前述方法难以判断浸润深度时,EUS 可以作为辅助诊断措施,效果明显。
3.内镜治疗技术
(1)EMR:EMR 指内镜下将黏膜病灶整块或分块切除、用于胃肠道表浅肿瘤诊断和治疗的方法。目前尚缺乏足够的EMR 治疗早期胃癌的前瞻性研究,不推荐使用 EMR 治疗早期胃癌。
(2)ESD:目前推荐 ESD 作为早期胃癌内镜下治疗的标准手术方式。
1)定义:ESD 是在 EMR 基础上发展起来的新技术,根据不同部位、大小、浸润深度的病变,选择使用的特殊电切刀,如 IT 刀、Dual 刀、Hook 刀等,内镜下逐渐分离黏膜层与固有肌层之间的组织,最后将病变黏膜及黏膜下层完整剥离的方法。
2)操作步骤:操作大致分为 5 步:①病灶周围标记;②黏膜下注射,使病灶明显抬起;③环形切开黏膜;④黏膜下剥离,使黏膜与固有肌层完全分离开,一次完整切除病灶;⑤创面处理:包括创面血管处理与边缘检查。
(3)其他治疗技术:内镜下其他治疗方法包括激光疗法、氩气刀和微波治疗等,它们只能去除肿瘤,但不能获得完整病理标本,也不能肯定肿瘤是否完整切除。因此,多用于胃癌前病变的治疗,治疗后需要密切随访,不建议作为早期胃癌的首选治疗方式。
4.早期胃癌内镜治疗适应症(表1)

早期胃癌内镜治疗的绝对适应证:肉眼可见黏膜内(cT1a)分化癌,必须无溃疡(瘢痕)发生,即 UL(–)。当侵犯深度、病变直径、分化程度和合并溃疡 UL(+)其中一项超出上述标准,淋巴结转移风险极低时,也可以考虑进行内镜治疗。对于 EMR/ESD 治疗后局部黏膜病灶复发患者,可行扩大适应证进行处理。
5.早期胃癌内镜治疗禁忌证
国内目前较为公认的内镜切除禁忌证为:
(1)明确淋巴结转移的早期胃癌;
(2)癌症侵犯固有肌层;
(3)患者存在凝血功能障碍。
ESD 的相对手术禁忌证还包括抬举征阴性,即指在病灶基底部的黏膜下层注射盐水后局部不能形成隆起,提示病灶基底部的黏膜下层与肌层之间已有粘连;此时行 ESD 治疗,发生穿孔的危险性较高,但是随着 ESD操作技术的熟练,即使抬举征阴性也可以安全地进行 ESD。
6.围手术期处理
(1)术前准备:术前评估患者全身状况,排除麻醉及内镜治疗禁忌证。取得患者及家属知情同意后,签署术前知情同意书。
(2)术后处理:术后第 1 天禁食;密切观察生命体征,无异常术后第 2 天进流质或软食。术后 1 周是否复查内镜尚存争议。
(3)术后用药:溃疡治疗:内镜下切除早期胃癌后溃疡,可使用质子泵抑制剂(PPI)或 H2受体拮抗剂(H2RA)进行治疗。抗菌药物使用:对于术前评估切除范围大、操作时间长和可能引起消化道穿孔者,可以考虑预防性使用抗菌药物。
7.术后并发症及处理
ESD 术后常见并发症主要包括出血、穿孔、狭窄、腹痛、感染等。
(1)出血:术中出血推荐直接电凝止血,迟发性出血可用止血夹或电止血钳止血。
(2)穿孔:术中穿孔多数病例可通过金属夹闭裂口进行修补。当穿孔较大时,常难以进行内镜治疗而需要紧急手术。
(3)狭窄:胃腔狭窄或变形发生率较低,主要见于贲门、幽门或胃窦部面积较大的 ESD 术后。内镜柱状气囊扩张是一种有效的治疗方式。
8.预后评估及随访
在内镜切除后的治愈性评价方面,现行内镜的治愈性切除和 R0 切除容易混淆。R0 切除意味着阴性切缘,但内镜下的阴性切缘并不能意味着治愈性切除。为统一预后评估标准,本指南推荐采用。


eCura C1:在分化型癌中,满足 eCura A 或 B 的其他条件,但未实现 en bloc 切除或 HM0 的局部未能完整切除的病例,即 eCura C1。可以采用局部治疗,例如再次行 ESD、内镜下消融等,同样也可以考虑到 ESD 的热效应,采取积极随访的办法。
eCura C2:病理提示淋巴结转移风险高。虽然存在较高的淋巴结转移风险,但是根据病例具体情况,在充分告知淋巴结转移风险后,可以选择 ESD 的方式给予治疗。值得关注的是 eCura C 患者在选择是否追加手术及手术时机的掌控方面尚存在争论,主要集中在以下 3 个方面。
(1)80%以上的 eCura C 患者并未出现局部复发或淋巴结转移。
(2)对于脉管浸润、神经侵犯、淋巴结侵犯及水平/垂直切缘等用于评价的危险因素在病变复发中起到的作用及影响尚需进一步细化。
(3)ESD 术后立即追加手术的 eCura C 患者与 ESD 术后发生局部复发再行手术的患者,在预后方面并无显著差异。
综上所述,eCura C 患者是否需要立即追加手术尚需更详细的临床研究数据支持。
(二)内镜下切除病理报告中的几个问题
1.肿瘤侵犯深度:肿瘤侵犯深度的判断是以垂直切缘阴性为前提的,黏膜下层的浸润深度还是判断病变是否完整切除的重要指标之一,侵犯黏膜下层越深则淋巴结转移的可能性越高。胃以500μm为界,不超过为SM1,超过为SM2。黏膜下层浸润深度的测量方法,根据肿瘤组织内黏膜肌层的破坏程度不同而不同。若肿瘤组织内尚可见残存的黏膜肌层,则以残存的黏膜肌层下缘为基准,测量至肿瘤浸润前锋的距离。若肿瘤组织内没有任何黏膜肌层,则以肿瘤最表面为基准,测量至肿瘤浸润前锋的距离。
2.切缘情况:组织标本的电灼性改变是ESD标本切缘的标志。切缘阴性是在切除组织的各个水平或垂直电灼缘均未见到肿瘤细胞。切缘阴性,但癌灶距切缘较近,应记录癌灶与切缘最近的距离;水平切缘阳性,应记录阳性切缘的块数;垂直切缘阳性,应记录肿瘤细胞所在的部位(固有层或黏膜下层)。电灼缘的变化对组织结构、细胞及其核的形态的观察会有影响,必要时可做免疫组织化学染色帮助判断切缘是否有癌灶残留。
3.脉管侵犯情况:ESD 标本有无淋巴管、血管(静脉)的侵犯是评判是否需要外科治疗的重要因素之一。肿瘤侵犯越深,越应注意有无侵犯脉管的状况。黏膜下浸润的肿瘤组织如做特殊染色或免疫组织化学染色(如CD31/CD34、D2-40),常能显示在HE染色中易被忽略的脉管侵犯。
4.有无溃疡和黏膜其他病变:胃的溃疡或溃疡瘢痕可影响ESD手术,以及对预后的判断,是病理报告中的一项重要内容。而周围黏膜的非肿瘤性病变,包括炎症、萎缩、化生等改变及其严重程度也应有所记录。
5.pT1低分化癌、脉管侵犯、切缘阳性,应当再行外科手术扩大切除范围。其他情况,内镜下切除充分即可,但术后需定期随访。
6.预后不良的组织学特征包括:低分化,血管、淋巴管浸润,切缘阳性。
7.阳性切缘定义为:肿瘤距切缘小于1mm或电刀/超声刀切缘可见癌细胞。